这份指南的全称是 《风湿性疾病药物的临床开发》,是FDA在2025年发布的一份行业指南,虽然现在已经过去了近十年,但这份指南中提出的核心原则和科学考量至今仍然是风湿病新药临床试验设计和执行的重要参考。
(图片来源网络,侵删)
指南的核心目的与重要性
我们需要理解为什么FDA会发布这样一份指南。
- 统一行业标准:风湿性疾病(如类风湿关节炎、系统性红斑狼疮、强直性脊柱炎等)种类繁多,异质性强,指南旨在为申办方(药企)提供一个统一、科学、高效的框架,用于设计和实施高质量的临床试验。
- 解决开发挑战:风湿病药物开发面临诸多挑战,例如疾病活动度评估的复杂性、安慰剂效应、合并用药的干扰等,指南旨在帮助申办方识别并应对这些挑战。
- 加速有效药物上市:通过提供清晰的监管期望,FDA可以更高效地审查申办方提交的药物申请,确保安全有效的药物能够更快地到达患者手中。
- 以患者为中心:指南强调在临床试验中使用对患者报告结局 进行评估,确保临床试验不仅关注实验室指标或医生评估,更能真实反映患者的感受和生活质量。
指南的核心内容概览
这份指南涵盖了风湿病药物临床开发的方方面面,主要包括以下几个关键部分:
临床试验设计与终点选择
这是指南的重中之重,FDA强调了终点选择的科学性和相关性。
-
主要终点:
 (图片来源网络,侵删)
(图片来源网络,侵删)- 核心要求:必须能够直接且可靠地测量药物的临床获益,对于症状改善明显的疾病(如类风湿关节炎),ACR20(美国风湿病学会20%改善标准)是公认的主要终点。
- 对于疾病修饰药物:主要终点应能证明其改变疾病进程的能力,而不仅仅是缓解症状。
- 单一主要终点 vs. 共同主要终点:鼓励使用单一、明确的主要终点,如果使用共同主要终点(同时评估症状改善和结构损伤进展),必须在试验方案中预先定义好统计分析和成功标准,以避免事后解读和数据挖掘。
-
关键次要终点:
用于支持或补充主要终点的结果,提供更全面的疗效证据,在以ACR20为主要终点的试验中,ACR50、ACR70、DAS28(疾病活动度评分28)缓解率等都是重要的次要终点。
-
探索性终点:
用于生成新的研究假设,但不能作为支持药物批准的主要或次要依据,探索特定生物标志物与疗效的关系。
 (图片来源网络,侵删)
(图片来源网络,侵删)
患者报告结局 的应用
这是2025年指南的一大亮点,体现了“以患者为中心”的理念。
- 重要性:PROs直接反映了患者对疼痛、功能、疲劳、生活质量等方面的主观感受,这些是传统医生评估无法完全覆盖的。
- 应用场景:
- 作为次要或探索性终点:使用HAQ-DI(健康评估问卷-残疾指数)来评估患者的身体功能改善。
- 作为共同主要终点:在某些情况下,PROs可以作为共同主要终点之一,尤其是在药物的主要疗效体现在改善患者生活质量时。
- PROs的质量要求:指南明确指出,用于监管决策的PROs工具必须经过严格的验证,确保其可靠性、有效性和敏感性。
特殊人群的考量
- 早期 vs. 晚期疾病患者:指南建议在早期患者中进行研究,因为此时患者对治疗反应更好,更能体现药物的疾病修饰潜力。
- 合并用药:风湿病患者常合并使用糖皮质激素、非甾体抗炎药和改善病情抗风湿药,指南要求在试验方案中明确规定合并用药的允许范围和停用标准,以评估研究药物的独立疗效和安全性。
- 安慰剂的使用:
- 伦理考量:在已有有效疗法的疾病中,使用安慰剂必须严格遵循伦理原则,通常用于“附加”试验(即在标准治疗基础上加用研究药或安慰剂)。
- 必要性:在某些情况下,安慰剂对照仍然是证明药物疗效的金标准。
安全性评估
- 常见不良反应:需要充分评估感染风险、肝肾功能、血液学指标等。
- 特殊关注:
- 机会性感染:对于免疫抑制剂和生物制剂,需特别关注结核、乙肝、疱疹病毒等再激活风险。
- 恶性肿瘤:长期使用免疫调节药物需评估潜在的致癌风险。
- 过敏反应:尤其是生物制剂,需关注输液反应和过敏反应。
- 长期安全性研究:对于需要长期使用的药物,通常要求在上市后开展长期的药物安全监测研究。
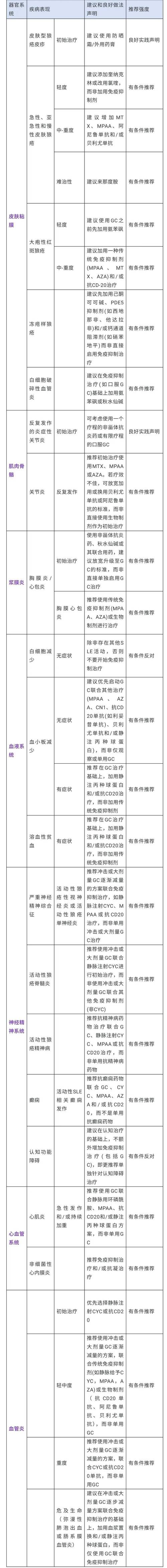
特定疾病的考量
指南虽然是一份通用性文件,但也提及了不同风湿病的特点:
- 类风湿关节炎:相对成熟,ACR标准、DAS评分、Sharp评分(评估X线片上的骨侵蚀)是核心工具。
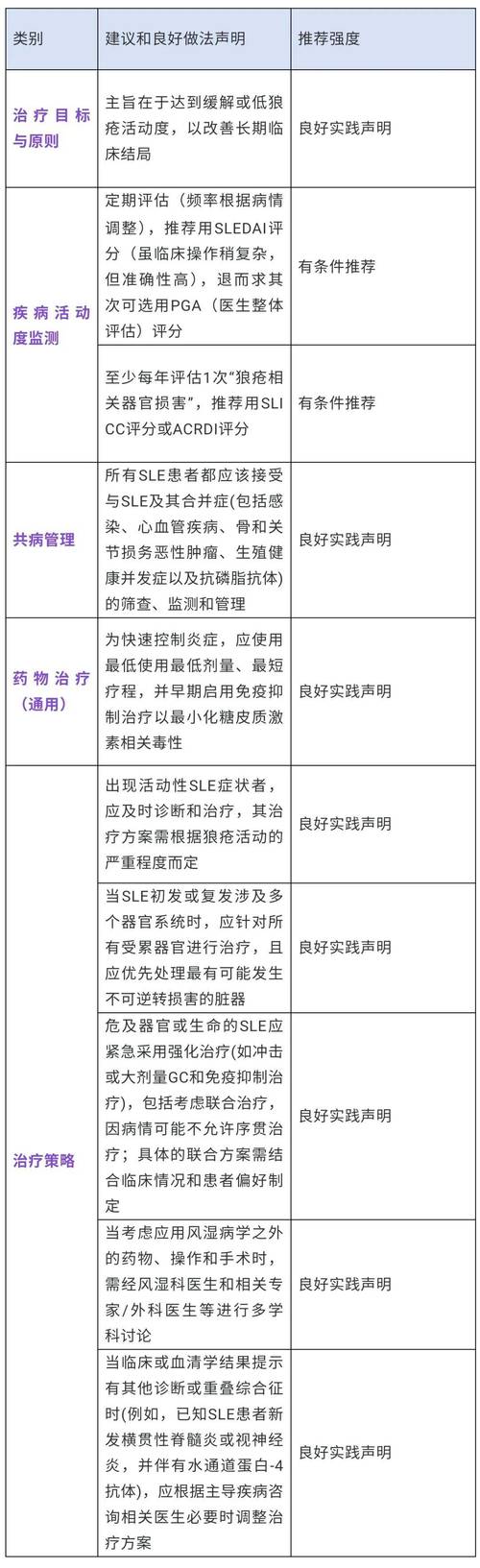
- 系统性红斑狼疮:疾病异质性极高,临床试验设计更具挑战性,过去缺乏公认的疗效评价工具,但近年来BILAG(英国狼疮评估组)和SLEDAI(系统性红斑狼疮疾病活动指数)等工具的应用逐渐增多。
- 强直性脊柱炎:核心是评估脊柱功能(如BASFI)、炎症(如BASDAI)和影像学改善(如mSASSS评分)。
对行业的影响与后续发展
2025年的风湿病指南对全球风湿病药物研发产生了深远影响:
- 提高了临床试验门槛和质量:申办方必须更加科学、严谨地设计试验,尤其是在终点选择和PROs应用方面。
- 推动了“以患者为中心”的研发理念:PROs的应用使得药物疗效的评价更加全面和人性化。
- 促进了监管科学的发展:FDA与申办方、学术界和患者组织的沟通更加顺畅,共同解决了许多研发难题。
后续发展:
- Lupus Nephritis(狼疮肾炎):在2025年后,FDA针对狼疮肾炎这一狼疮严重的并发症,发布了专门的指南,提出了基于肾脏缓解率的新型替代终点,极大地推动了该领域新药的研发。
- SLE总体疾病活动度:对于非肾脏受累的SLE,监管机构和学术界仍在探索和验证能够替代传统安慰剂对照试验的新型疗效终点。
FDA 2025年风湿病指南是一份里程碑式的文件,它为风湿病新药的临床开发提供了一个科学、全面且人性化的框架,其核心思想可以概括为:
- 科学性:以可靠、相关的终点为核心证据。
- 严谨性:在试验设计、执行和分析中保持高标准。
- 以患者为中心:重视PROs,确保药物的临床获益对患者有意义。
对于任何从事风湿病药物研发的人员(无论是药企、CRO还是临床研究者)深入理解并遵循这份指南中的原则,都是成功开发新药的关键,虽然部分细节可能随着科学进步而更新,但其核心理念至今仍具有强大的指导意义。




